(A) 0,1 a 0,5 mA/cm2.
(B) 0,6 a 0,9 mA/cm2.
(C) 1 a 5 mA/cm2
(D) 10 a 50 mA/cm2.
(E) 100 a 500 mA/cm2.
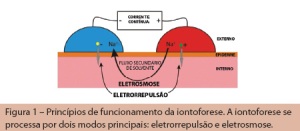
Esse é um tema que cai com frequência em concurso, mas não muito comum na prática clínica da maioria dos fisioterapeutas. Na iontoforese, o transporte de substâncias através da pele a 0,1 mA/cm2 ocorre principalmente via anexos cutâneos, como folículos pilosos e glândulas sudoríparas.
IONTOFORESE
A aplicação de uma corrente elétrica fraca para transferir substâncias carregadas através de membranas biológicas, ou seja, a iontoforese, não é uma técnica nova. Ela foi primeiramente descrita por Veratti em 1748 e vem sendo modificada ao longo dos anos de acordo com as necessidades e capacidade tecnológica.
No final do século XIX, Morton escreveu um livro sobre a cataforese de íons nos tecidos, isto é, a migração de cátions de um eletrodo positivo em direção a um eletrodo de polaridade negativa. Neste livro o autor descreve um experimento conduzido em seu próprio braço. Nele, grafite em pó foi colocada em contato com um eletrodo positivo e a aplicação de uma corrente elétrica provocou o aparecimento de pequenas manchas pretas no local, que persistiram por várias semanas.
No início do século XX, Leduc mostrou que a iontoforese poderia ser usada para levar princípios ativos através da pele usando dois coelhos conectados em série a um gerador de corrente. Soluções de estricnina e de cianeto foram colocadas em contato com a pele dos animais e uma corrente elétrica foi aplicada. Sem a aplicação da corrente elétrica nada aconteceu aos coelhos. No entanto, após a aplicação da corrente, o coelho ao qual foi aplicada estricnina apresentou convulsões tetânicas, enquanto o segundo morreu apresentando sintomas de envenenamento por cianeto. Desde então a iontoforese é utilizada e extensivamente investigada para promover a liberação de fármacos através de vários epitélios, como mucosas, cérvix, olhos, unhas e, principalmente, pele no tratamento de diversas patologias.
A administração de fármacos na pele, seja para um tratamento local (tópico) ou sistêmico (transdérmico), baseia-se na difusão do fármaco através das diversas camadas da epiderme. A camada mais superficial deste tecido, o estrato córneo, mantém o conteúdo de água no organismo mesmo em condições climáticas variáveis, bem como limita a absorção de substâncias tóxicas do ambiente. Sendo assim, o estrato córneo apresenta excelentes propriedades de barreira para a penetração de fármacos na pele, o que limita a liberação de um grande número de substâncias por esta via. A maioria dos fármacos liberados pelos sistemas transdérmicos convencionais são moléculas pequenas, potentes e relativamente lipofílicas. A administração cutânea de fármacos polares e que apresentam carga é particularmente difícil, devido à lipofilicidade intrínseca do estrato córneo. A iontoforese apresenta o potencial de vencer várias limitações associadas à liberação transdérmica, como promover a penetração de moléculas polares e de grande massa molecular, aumentar a liberação de substâncias de meia-vida curta diretamente nos tecidos, além de permitir um melhor controle no transporte de fármacos, garantindo dosagem adequada e boa aceitação pelo paciente.
A baixa variabilidade biológica paciente/paciente promovida pelo controle da corrente elétrica é outra vantagem da iontoforese quando comparada à administração passiva (sem corrente elétrica) de substâncias. Singh e colaboradores estudaram o efeito da iontoforese de uma solução salina na função barreira da pele e possíveis ocorrências de irritação local em pessoas de quatro grupos étnicos, analisando a perda de água transepidermal (TEWL), a capacitância e temperatura cutânea. Eles não observaram diferenças significativas dos parâmetros analisados entre os diferentes grupos citados após 4 horas de iontoforese. Estes dados sugerem, portanto, que a iontoforese de um determinado fármaco deve levar à penetração cutânea de quantidades semelhantes da substância administrada, independente do grupo étnico ao qual o paciente pertença, uma vez que os parâmetros estudados por Singh influenciam diretamente a penetração cutânea de substâncias.
Apesar de desde 1900 se saber que a iontoforese aumenta a penetração de fármacos na pele, ela começou a ser estudada com maior atenção somente em meados de 1980. Existem alguns fatores principais que contribuíram para este interesse renovado pela técnica. O primeiro deles está relacionado com a terapia transdérmica. A aceitabilidade e o sucesso financeiro dos dispositivos transdérmicos passivos de nicotina, fentanil, nitroglicerina e estradiol estimulou o interesse das indústrias farmacêuticas em trabalhar com outros fármacos que pudessem ser liberados pela via transdérmica. O avanço da biotecnologia, com o descobrimento de grande número de peptídeos e proteínas com importância terapêutica indiscutível, mas muito grandes para serem liberados passivamente através da pele, também contribuiu para um maior interesse no uso da iontoforese.
Um grande avanço nas possibilidades de utilização da iontoforese foi possível após o desenvolvimento de microprocessadores, quando, em 1971, a Intel Corporation introduziu no mercado o primeiro microprocessador. O avanço na tecnologia e indústria de microeletrônicos tornou possível miniaturizar os componentes eletrônicos programáveis do dispositivo iontoforético a um custo mais baixo. Estudos demonstram que através de microcontroladores eletrônicos programáveis pode-se obter dispositivos com esquemas posológicos complexos. Dispositivos iontoforéticos bem desenvolvidos são capazes, por exemplo, de mimetizar a secreção fisiológica natural de um hormônio como se fossem glândulas endócrinas artificiais, liberando o fármaco de maneira pulsátil ou contínua enquanto o paciente dorme. O hormônio de liberação do hormônio luteinizante (LHRH), por exemplo, pode ser liberado de maneira contínua para o tratamento do câncer de próstata e de maneira pulsátil para o tratamento da infertilidade. Além disso, o controlador eletrônico pode ser ligado ou desligado quando necessário e, como o fármaco só é liberado na presença da corrente elétrica, o simples desligamento do controlador eletrônico provocará a diminuição do nível plasmático do fármaco. Esta característica permite a utilização da iontoforese na administração de opióides. Desta forma, quando o paciente sente dor ele ativa o dispositivo, o qual libera imediatamente uma grande quantidade do fármaco na corrente sanguínea.
Atualmente, um dispositivo controlado pelo paciente para liberação iontoforética de fentanil foi aprovado nos Estados Unidos e Europa para tratamento de dor pós-operatória aguda e moderada em adultos hospitalizados. Vários estudos clínicos comprovam a equivalência terapêutica entre o uso deste dispositivo e a administração intravenosa de morfina. Essa grande versatilidade e facilidade de aplicação fazem com que o paciente siga corretamente a terapia que lhe foi prescrita, com baixo índice de desistência.
Para se conseguir uma permeação adequada de um fármaco por iontoforese, ou seja, para que o fármaco atinja a camada desejada da membrana ou atravesse-a e caia na circulação com concentração plasmática e velocidade de liberação controladas, aspectos químicos, físicos e fisico-químicos da formulação que será submetida à iontoforese devem ser levados em consideração.
PRINCÍPIOS BÁSICOS
A corrente elétrica é fornecida por uma fonte de energia ou bateria e distribuída com o auxílio de um eletrodo positivo (ânodo) e um eletrodo negativo (cátodo) através de uma solução eletrolítica que segue para a pele e vai para o sistema circulatório. Quando a corrente é aplicada, os cátions presentes na solução em contato com o ânodo se movem em direção ao cátodo, enquanto os ânions presentes no cátodo se movem na direção oposta. A presença de cada tipo de íon (cátions e ânions) ou moléculas carregadas no sistema conduz uma fração de corrente elétrica denominada número de transporte. A razão máxima do transporte de um dado íon ocorre quando o número de transporte para o íon é igual a 1, isto é, quando o íon sozinho é capaz de conduzir 100% da corrente através da membrana.
Para otimizar o transporte iontoforético desses íons é necessário adequar dispositivos iontoforéticos e formulações compatíveis com eles, isto porque o transporte de íons é dependente de vários fatores relacionados ao dispositivo iontoforético e à formulação utilizada. Sendo assim, o fluxo iontoforético de um fármaco pode ser aumentado através da alteração de fatores elétricos, como a densidade e a natureza da corrente e o tipo de eletrodo utilizado. Na formulação podem ser modificados a concentração do fármaco, a concentração de outros íons, o pH e a força iônica.
Os eletrodos utilizados nos experimentos de iontoforese devem ser escolhidos para garantir a eletroneutralidade do sistema e os processos eletroquímicos desejados na interface eletrodo-solução e, assim, maximizar a liberação iontoforética do fármaco em estudo. Desta maneira, os eletrodos devem ter propriedades bem delineadas, pois, de seu comportamento depende a condução estável da corrente elétrica necessária para a liberação controlada do fármaco por iontoforese. Eles devem ser capazes de sustentar uma alta densidade de corrente sem causar alterações no pH da solução que está em contato, perda de material da superfície do eletrodo ou formação de bolhas de gás. Devem ser também mecanica e quimicamente estáveis na solução que estão em contato e relativamente fáceis de serem obtidos. E por fim, a substância submetida à corrente elétrica com tais eletrodos não deve ser alterada pelas propriedades químicas desses eletrodos.
Os eletrodos convencionalmente empregados na iontoforese podem ser classificados como inertes (metais como aço inoxidável, platina ou alumínio) ou reversíveis (Ag e AgCl), sendo os últimos mais estudados e utilizados. Os eletrodos inertes provocam a hidrólise da água, produzindo íons hidroxila e hidrônio, que podem competir com o fármaco ionizado, reduzindo o número de transporte deste e, dessa forma, sua penetração pela pele. Além disso, a eletrólise da água pode alterar o pH da solução doadora, degradar o fármaco ou alterar sua ionização, prejudicando assim o controle de sua liberação. A diminuição do pH pode também causar uma sensação de ardência no local de aplicação do fármaco.
Já os eletrodos reversíveis de Ag/AgCl são mais funcionais do que os eletrodos inertes devido a sua cinética extremamente rápida e à relativamente alta condutividade do cloreto de prata. Eles não causam variação de pH, pois suas trocas eletroquímicas ocorrem em uma voltagem inferior à necessária para que haja a eletrólise da água.
A Figura 1 ilustra a aplicação de um potencial elétrico e o deslocamento da corrente elétrica pelo circuito na presença de eletrodos reversíveis de Ag e AgCl.
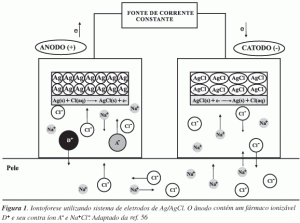
Pode-se observar na Figura 1 que as reações eletroquímicas no ânodo (eletrodo de Ag) necessitam da presença de íons Cl-, os quais reagem com a prata e formam cloreto de prata. Este, por sua baixa solubilidade, é simultaneamente depositado na superfície do eletrodo liberando um elétron. Para manter a neutralidade elétrica do sistema, ou um cátion deixa este compartimento e move-se através da pele, ou um ânion presente na pele migra em direção ao ânodo.
VIAS DE PERMEAÇÃO CUTÂNEA
A pele é um dos maiores órgãos do corpo humano, pesando, em um adulto, por volta de 4 kg, cobrindo uma superfície de cerca de 2 m2 e recebendo aproximadamente da circulação sanguínea do corpo. Com a espessura de apenas alguns milímetros (2,97 ± 0,28 mm), a pele separa a rede de circulação sanguínea e os demais órgãos do corpo do ambiente externo, ajudando a manter a temperatura corporal, evitando a perda excessiva de água pelo corpo, além de proteger o indivíduo contra a entrada de agentes químicos e ambientais danosos, particularmente infecciosos (bactérias e vírus), impurezas e radiação solar.
Além disso, possui funções metabólicas, imunológicas e táteis.59 Observam-se ainda várias estruturas anexas, que são os pêlos, as unhas e as glândulas sudoríparas e sebáceas.
A pele apresenta-se constituída por uma porção epitelial de origem ectodérmica, a epiderme, e uma porção conjuntiva de origem mesodérmica, a derme. O limite entre a epiderme e a derme não é regular, apresentando saliências e reentrâncias das duas camadas que imbricam e se ajustam entre si.
Abaixo e em continuidade com a derme está a hipoderme, que, embora tenha a mesma origem da derme, não faz parte da pele. Este tecido subcutâneo funciona como uma reserva de gordura, com propriedades isolantes e protetoras; não possui um papel na penetração cutânea de fármacos porque se situa abaixo do sistema vascular. O acúmulo de gordura neste tecido representa um dos fatores contribuintes para a força tênsil da pele.
A derme é formada por uma rede de fibras de colágeno de uma espessura aproximadamente uniforme, que são responsáveis pelas propriedades elásticas da pele.
A camada superior da derme é formada por papilas que se projetam em direção à epiderme e que contêm vasos sanguíneos e linfáticos, as terminações nervosas e os apêndices cutâneos, como folículos pilosos, glândulas sebáceas e sudoríparas.
A epiderme pode ser dividida em duas partes: epiderme viável, parte mais interna na qual as células se proliferam, sofrem alterações e dão origem às células mortas do estrato córneo; estrato córneo, parte mais superficial, de grande importância para os estudos de penetração cutânea.
O estrato córneo é formado por uma estrutura bifásica de lipídio-proteína e tem aproximadamente de 10 a 20 µm de espessura,61 sendo composto por células anucleadas (corneócitos) dispersas em uma matriz rica em lipídios não polares. Essa matriz é constituída principalmente por ceramidas (18%), ácidos graxos livres (19%), esteróides (14%) e triacilgliceróis (25%).
O estrato córneo requer no mínimo 10% de umidade para que sua flexibilidade seja mantida, e a camada de lipídios intercelulares é a responsável direta por evitar a perda de água transcutânea. Assim, pela sua estrutura e composição, o estrato córneo é a principal barreira limitante à difusão percutânea de fármacos.
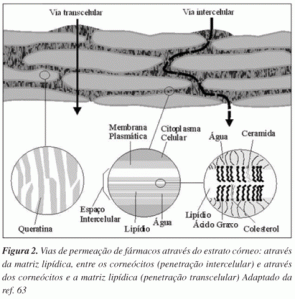
Um fármaco pode atravessar o estrato córneo através de três diferentes vias (Figura 2). São elas a via intercelular: o fármaco difunde-se ao redor dos corneócitos, permanecendo constantemente dentro da matriz lipídica; via transcelular: o fármaco passa diretamente através dos corneócitos e da matriz lipídica intercelular intermediária; via apêndices: rota paralela, na qual os fármacos podem ser absorvidos pelo folículo piloso, glândulas sebáceas e glândulas sudoríparas.
A importância de cada via de permeação depende das propriedades físico-químicas do fármaco e das características da membrana. Em condições normais, ou seja, na ausência de corrente elétrica, a penetração transdérmica de fármacos se restringe a poucas moléculas, que devem ser, necessariamente, potentes (capazes de atingir o efeito terapêutico em baixas concentrações), pequenas (Massa Molar < 400 g/mol) e ligeiramente lipofílicas (para se partilharem através das camadas da epiderme).
Na iontoforese, no entanto, o transporte de substâncias através da pele sob condições moderadas (0,1 mA/cm2) ocorre principalmente via anexos cutâneos, como folículos pilosos e glândulas sudoríparas. Esses anexos atuam como vias alternativas de baixa resistência ao transporte de substâncias exógenas.
Assim, na iontoforese, o estrato córneo deixa de ser a principal barreira relevante à penetração, uma vez que as moléculas atravessam a epiderme por "vias alternativas", sendo então possível a liberação de macromoléculas e moléculas polares, ampliando as possibilidades terapêuticas utilizando a via transdérmica.
Ademais, o transporte de íons pela via intercelular também ocorre na iontoforese. Estudos utilizando espectroscopia eletrônica, microscopia de fluorescência e microscopia confocal a laser confirmam a diminuição da resistência do estrato córneo quando este é submetido a uma corrente elétrica fraca. Essa queda na resistência da pele ocorre devido à formação de poros aquosos, ou seja, regiões polares na lamela lipídica. Fatouros e colaboradores observaram através de microscopia eletrônica a formação desses poros aquosos em estudos in vitro de iontoforese utilizando pele humana proveniente de cirurgias plásticas.
Ainda, em estudos de iontoforese in vivo, esses autores observaram um enfraquecimento nas estruturas dos desmossomos. Os desmossomos são estruturas protéicas que formam uma ponte entre corneócitos vizinhos. Seu enfraquecimento facilita a penetração de substâncias pela pele. As causas deste enfraquecimento ainda não são conclusivas, podendo ter uma relação direta ou indireta com a corrente elétrica. O efeito direto está obviamente relacionado à aplicação da própria eletricidade, que pode fragilizar os desmossomos. O efeito indireto deve-se ao aumento do conteúdo aquoso causado pela aplicação da corrente elétrica.
MECANISMOS DE TRANSPORTE IONTOFORÉTICO
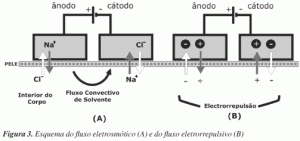
Existem várias análises detalhadas sobre os mecanismos envolvendo o fenômeno iontoforético e o transporte das moléculas de fármacos através da pele, sendo os dois mais aceitos a eletrorrepulsão e a eletrosmose, conforme esquematizado abaixo:
FONTE: http://www.scielo.br/pdf/qn/v31n6/a40v31n6.pdf
Alternativa assinalada no gabarito da banca organizadora: A
Alternativa que indico após analisar: A

Nenhum comentário:
Postar um comentário